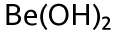En Química,
un enlace iónico o electrovalente es la unión de átomos que resulta de la presencia de
atracción electrostática entre los iones de distinto signo, es decir, uno
fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo(alta afinidad electrónica). Eso se da cuando en
el enlace, uno de los átomos capta electrones del otro. La
atracción electrostática entre los iones de carga opuesta causa que se unan y
formen un compuesto químico simple, aqui no se fusionan
sino uno da y otro recibe.
Dado que los
elementos implicados tienen elevadas diferencias de electronegatividad, este
enlace suele darse entre un compuesto metálico y uno no metálico. Se produce
una transferencia electrónica total de un átomo a otro formándose iones de
diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego
ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene
configuración electrónica estable. Son estables pues ambos, según la regla del
octeto o por la estructura de Lewis adquieren 8 electrones en su capa más
exterior (capa de valencia), aunque esto no es del todo cierto ya que
contamos con varias excepciones, la del hidrógeno (H) que se llega al octeto con 2
electrones, el berilio(Be) con 4 ,el aluminio (Al) y el boro (B) que se rodean de seis.
Los compuestos iónicos forman
redes cristalinas constituidas por iones de carga opuesta, unidos por fuerzas
electrostáticas. Este tipo de atracción determina las propiedades observadas.
En el siguiente video se mostrara mas claramente lo que es un enlace iónico.
Aquí se les mostrara imágenes con algunos ejemplos de enlaces iónicos con elementos.
Aquí esta la representación de como el átomo de la izquierda le sede un electrón al de la derecha para a completar 8 electrones.
Redes cristalinas
La red cristalina está formada por iones de signo opuesto,
de manera que cada uno crea a su alrededor un campo eléctrico que posibilita
que estén rodeados de iones contrarios.
Los sólidos cristalinos mantienen sus iones prácticamente en
contacto mutuo, lo que explica que sean prácticamente incompresibles. Además,
estos iones no pueden moverse libremente, sino que se hallan dispuestos en
posiciones fijas distribuidas desordenadamente en el espacio formando retículos
cristalinos o redes espaciales. Los cristalográficos clasifican los retículos
cristalinos en siete tipos de poliedros llama sistemas cristalográficos. En
cada uno de ellos los iones pueden ocupar los vértices, los centros de las
caras o el centro del cuerpo de dichos poliedros. El más sencillo de éstos
recibe el nombre de celdilla unidad.
Uno de los parámetros básicos de todo cristal es el llamado
índice de coordinación que podemos definir como el número de iones de un signo
que rodean a un ion de signo opuesto. Podrán existir, según los casos, índices
diferentes para el catión y para el anión.
En este video veremos un experimento (por así decirlo) sobre lo que son las redes cristalinas.
Aquí una imágenes sobre las redes cristalinas.
Ductilidad
La ductilidad es una propiedad que presentan algunos
materiales, como las aleaciones metálicas o materiales asfálticos, los cuales
bajo la acción de una fuerza, pueden deformarse sostenible mente sin romperse,1
permitiendo obtener alambres o hilos de dicho material. A los materiales que
presentan esta propiedad se les denomina dúctiles. Los materiales no dúctiles
se clasifican de frágiles. Aunque los materiales dúctiles también pueden llegar
a romperse bajo el esfuerzo adecuado, esta rotura sólo se produce tras
producirse grandes deformaciones.
En otros términos, un material es dúctil cuando la relación
entre el alargamiento longitudinal producido por una tracción y la disminución
de la sección transversal es muy elevada.
En el ámbito de la metalurgia se entiende por metal dúctil
aquel que sufre grandes deformaciones antes de romperse, siendo el opuesto al
metal frágil, que se rompe sin apenas deformación.
No debe confundirse dúctil con blando, ya que la ductilidad
es una propiedad que como tal se manifiesta una vez que el material está
soportando una fuerza considerable; esto es, mientras la carga sea pequeña, la
deformación también lo será, pero alcanzado cierto punto el material cede,
deformándose en mucha mayor medida de lo que lo había hecho hasta entonces pero
sin llegar a romperse.
Videos relacionados:
Imágenes:


Solvatación.
La solvatación es el proceso de asociación de moléculas de
un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un
soluto, se dispersan y son rodeados por moléculas de solvente. A mayor tamaño
del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se
encuentra el ion. La razón de ello es que la fuerza electrostática entre el
núcleo del ion y la molécula del solvente disminuye de forma marcada con la
distancia entre la molécula de solvente y el núcleo del ion. Así, el ion más
grande se une fuertemente con el solvente y por ello se rodea de un gran número
de moléculas de solvente.
Diferencia entre solvatación, disolución y
solubilidad
Videos:
I magenes: